Ce sunt blocurile de elemente?
 Share
Share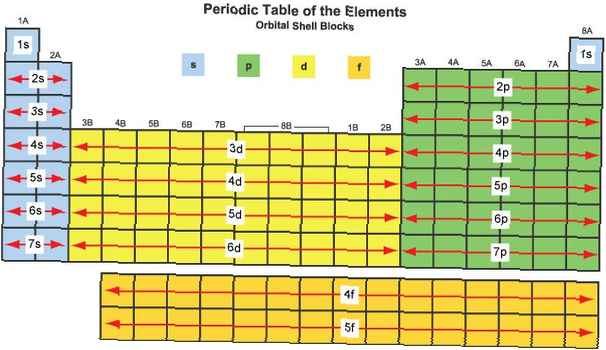
O modalitate de a grupa elemente este prin blocuri de elemente, uneori cunoscute sub numele de familii de elemente. Blocurile de elemente sunt distincte de perioade și grupuri, deoarece au fost dezvoltate pe baza unui mod foarte diferit de clasificare a atomilor.
Ce este un bloc de elemente?
Un bloc de elemente este un set de elemente situate în grupuri de elemente adiacente. Charles Janet a aplicat prima dată termenul (în franceză). Numele blocurilor (s, p, d, f) provin din descrieri ale liniilor spectroscopice ale orbitalelor atomice: ascuțit, principal, difuz și fundamental. Nu au fost observate până în prezent elemente de blocare g, dar litera a fost aleasă, deoarece este urmată în ordine alfabetică după „f”.
Ce elemente intră în ce bloc?
Blocurile de elemente sunt denumite pentru orbitalul lor caracteristic, care este determinat de electronii cu cea mai mare energie:
s-bloc
Primele două grupuri ale tabelului periodic, metalele s-bloc:
- sunt fie metale alcaline, fie metale alcaline de pământ
- sunt moi și au puncte mici de topire
- sunt electropozitive și active din punct de vedere chimic
p-bloc
Elementele cu bloc P includ ultimele șase grupe de elemente ale tabelului periodic, cu excepția heliului. Elementele p-bloc includ toate nemetalele, cu excepția hidrogenului și heliului, a semimetalelor și a metalelor post-tranziție. Elemente de bloc P:
- includ carbon, azot, oxigen, sulf, halogeni și multe alte elemente comune
- interacționează cu alte substanțe chimice pierzând, câștigând sau împărțind electronii de valență
- în cea mai mare parte formează compuși covalenți (deși halogenii formează compuși ionici cu metale blocate
d-bloc
Elementele blocului D sunt metale de tranziție ale grupurilor de elemente 3-12. Elemente de bloc D:
- au electroni de valență în cele două exterioare și învelișuri
- „elementele bloc” se comportă într-o manieră care este undeva între cea a metalelor alcaline electropozitive extrem de reactive și elementele care formează compusul covalent (motiv pentru care sunt denumite „elemente de tranziție”)
- au puncte de topire și fierbere ridicate
- formează de obicei săruri colorate
- sunt în general catalizatori buni
f-bloc
Elemente de tranziție interioară, de obicei seriile lantanide și actinide, inclusiv lantanul și actiniul. Aceste elemente sunt metale care au:
- puncte de topire ridicate
- stări de oxidări variabile
- capacitatea de a forma săruri colorate
g-bloc (Propus)
Se așteaptă ca blocul G să includă elemente cu numere atomice mai mari de 118.
