Tipuri de reacții chimice
 Share
Share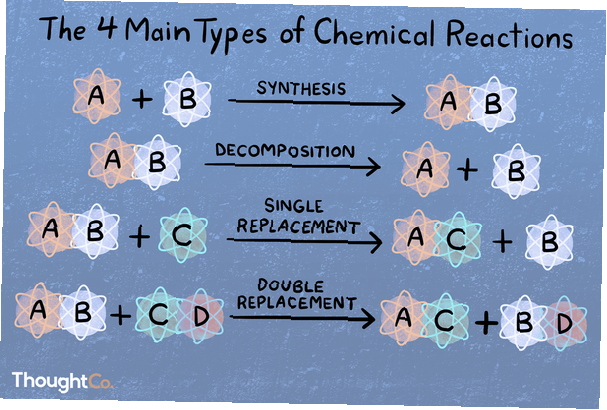
O reacție chimică este un proces caracterizat în general printr-o schimbare chimică în care materiile prime (reactanți) sunt diferite de produse. Reacțiile chimice tind să implice mișcarea electronilor, ceea ce duce la formarea și ruperea legăturilor chimice. Există mai multe tipuri diferite de reacții chimice și mai multe moduri de clasificare a acestora. Iată câteva tipuri comune de reacție:
Oxidare-reducere sau reacție Redox
Într-o reacție redox, se modifică numărul de oxidare a atomilor. Reacțiile Redox pot implica transferul electronilor între speciile chimice.
Reacția care apare atunci când În care eu2 se reduce la I- și S2O32- (anion tiosulfat) este oxidat la S4O62- oferă un exemplu de reacție redox:
2 S2O32-(aq) + I2(aq) → S4O62-(aq) + 2 I-(Aq)
Combinație directă sau reacție de sinteză
Într-o reacție de sinteză, două sau mai multe specii chimice se combină pentru a forma un produs mai complex.
A + B → AB
Combinația de fier și sulf pentru a forma sulfura de fier (II) este un exemplu de reacție de sinteză:
8 Fe + S8 → 8 FeS
Reacție chimică de descompunere sau analiză
Într-o reacție de descompunere, un compus este spart în specii chimice mai mici.
AB → A + B
Electroliza apei în oxigen și hidrogen gaz este un exemplu de reacție de descompunere:
2 H2O → 2 H2 + O2
Reacție unică de deplasare sau de substituție
O reacție de substituție sau de deplasare unică este caracterizată prin aceea că un element este deplasat dintr-un compus de un alt element.
A + BC → AC + B
Un exemplu de reacție de substituție apare atunci când zincul se combină cu acid clorhidric. Zincul înlocuiește hidrogenul:
Zn + 2 HCl → ZnCl2 + H2
Metateza sau dubla reacție de deplasare
Într-o dublă reacție de deplasare sau metateză, doi compuși schimbă legături sau ioni pentru a forma compuși diferiți.
AB + CD → AD + CB
Un exemplu de reacție dublă de deplasare are loc între clorura de sodiu și nitratul de argint pentru a forma nitrat de sodiu și clorură de argint.
NaCl (aq) + AgNO3(aq) → NaNO3(aq) + AgCl (s)
Reacția acido-bazică
O reacție acid-bază este un tip de reacție de deplasare dublă care are loc între un acid și o bază. H+ ionul din acid reacționează cu OH- ion în bază pentru a forma apă și o sare ionică:
HA + BOH → H2O + BA
Reacția dintre acidul bromhidric (HBr) și hidroxidul de sodiu este un exemplu de reacție acid-bază:
HBr + NaOH → NaBr + H2O
Combustie
O reacție de combustie este un tip de reacție redox în care un material combustibil se combină cu un oxidant pentru a forma produse oxidate și a genera căldură (reacție exotermică). De obicei, într-o reacție de ardere, oxigenul se combină cu un alt compus pentru a forma dioxid de carbon și apă. Un exemplu de reacție de ardere este arderea naftalinei:
C10H8 + 12 O2 → 10 CO2 + 4 H2O
izomerizarea
Într-o reacție de izomerizare, aranjamentul structural al unui compus este schimbat, dar compoziția sa atomică netă rămâne aceeași.
Reacția de hidroliză
O reacție de hidroliză implică apă. Forma generală pentru o reacție de hidroliză este:
X-(aq) + H2O (l) ↔ HX (aq) + OH-(Aq)
Principalele tipuri de reacție
Există sute sau chiar mii de tipuri de reacții chimice! Dacă vi se cere să numiți principalele 4, 5 sau 6 tipuri de reacții chimice, iată cum sunt clasificate acestea. Principalele patru tipuri de reacții sunt combinația directă, reacția de analiză, deplasarea unică și deplasarea dublă. Dacă vi se întreabă cele cinci tipuri principale de reacții, este vorba de aceste patru, apoi de acid-bază sau redox (în funcție de cine întrebați). Rețineți că, o reacție chimică specifică poate intra în mai multe categorii.
