Definiția osmozei în chimie
 Share
Share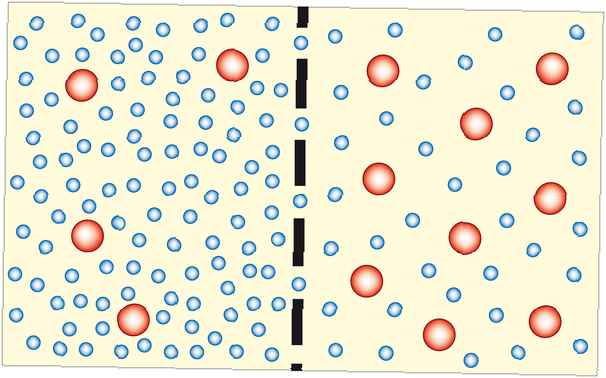
Două procese importante de transport în masă în chimie și biologie sunt difuzia și osmoza.
Definiția osmozei
Osmoză este procesul prin care moleculele de solvent se deplasează printr-o membrană semipermeabilă dintr-o soluție diluată într-o soluție mai concentrată (care devine mai diluată). În majoritatea cazurilor, solventul este apa. Cu toate acestea, solventul poate fi un alt lichid sau chiar un gaz. Osmoza poate fi făcută pentru a lucra.
Istorie
Fenomenul osmozei a fost pentru prima dată documente în 1748 de Jean-Antoine Nollet. Termenul de „osmoză” a fost inventat de medicul francez René Joachim Henri Dutrochet, care l-a derivat din termenii „endosmoză” și „exosmoză”.
Cum funcționează osmoza
Osmoza acționează pentru egalizarea concentrației pe ambele părți ale unei membrane. Deoarece particulele de solutie sunt incapabile să traverseze membrana, apa (sau alt solvent) care trebuie să se miște. Cu cât sistemul ajunge mai aproape de echilibru, cu atât devine mai stabil, astfel încât osmoza este favorabilă termodinamic.
Exemplu de osmoză
Un bun exemplu de osmoză este văzut atunci când globulele roșii sunt introduse în apă dulce. Membrana celulară a globulelor roșii este o membrană semipermeabilă. Concentrația de ioni și alte molecule de solut este mai mare în interiorul celulei decât în afara ei, astfel încât apa se deplasează în celulă prin osmoză. Acest lucru face ca celulele să se umfle. Deoarece concentrația nu poate atinge echilibrul, cantitatea de apă care se poate deplasa în celulă este moderată de presiunea membranei celulare care acționează asupra conținutului celulei. Adesea, celula ia mai multă apă decât poate susține membrana, ceea ce face ca celula să izbucnească.
Un termen înrudit este presiunea osmotică. Presiunea osmotică este presiunea externă care ar trebui aplicată astfel încât să nu existe nicio mișcare netă de solvent pe o membrană.
