Tabelul periodic al elementelor Torium
 Share
Share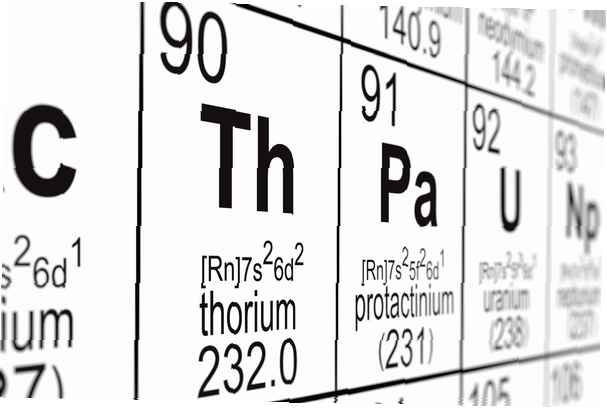
Numar atomic: 90
Simbol: Th
Greutate atomica: 232.0381
Descoperire: Jons Jacob Berzelius 1828 (Suedia)
Configuratie electronica: [Rn] 6d2 7s2
Originea cuvântului: Numit pentru Thor, zeul norvegian al războiului și al tunetului
izotopi: Toate izotopii de toriu sunt instabili. Masele atomice variază între 223 și 234. Th-232 apare în mod natural, cu un timp de înjumătățire plasmatică de 1,41 x 1010 ani. Este un emițător alfa care trece prin șase alfa și patru trepte de descompunere beta pentru a deveni izotopul stabil Pb-208.
Proprietăți: Thorium are un punct de topire de 1750 ° C, punct de fierbere ~ 4790 ° C, cu o greutate specifică de 11,72, cu o valență de +4 și uneori +2 sau +3. Metalul pur de toriu este un alb argintiu stabil, care poate să-și păstreze strălucirea timp de luni. Toriul pur este moale, foarte ductil și capabil să fie desenat, înclinat și laminat la rece. Toriul este dimorf, trecând de la o structură cubică la o structură cubică centrată pe corp la 1400 ° C. Punctul de topire al oxidului de toriu este de 3300 ° C, care este cel mai înalt punct de topire al oxizilor. Toriul este atacat lent de apă. Nu se dizolvă ușor în majoritatea acizilor, cu excepția acidului clorhidric. Toriul contaminat de oxidul său se va încetini încet până la cenușiu și în cele din urmă negru. Proprietățile fizice ale metalului depind foarte mult de cantitatea de oxid prezentă. Toriul sub formă de pulbere este pirofor și trebuie manipulat cu grijă. Încălzirea transformărilor de toriu în aer le va determina să se aprindă și să ardă cu o lumină albă strălucitoare. Toriul se dezintegrează pentru a produce gaz radon, un emițător alfa și un pericol de radiație, astfel încât zonele în care este depozitat sau manipulat toriu necesită o bună ventilație.
utilizari: Toriul este utilizat ca sursă de energie nucleară. Căldura internă a pământului este în mare măsură atribuită prezenței de toriu și uraniu. Toriul este de asemenea utilizat pentru luminile portabile cu gaz. Toriul este aliat cu magneziu pentru a oferi rezistență la fluaj și rezistență ridicată la temperaturi ridicate. Funcția scăzută de lucru și emisiile ridicate de electroni fac ca toriul să fie util pentru acoperirea sârmei de wolfram utilizat în echipamentele electronice. Oxidul este utilizat pentru fabricarea creuzetelor și a sticlei cu o dispersie scăzută și un indice ridicat de refracție. Oxidul este de asemenea utilizat ca catalizator pentru transformarea amoniacului în acid azotic, pentru producerea acidului sulfuric și pentru crăparea petrolului.
surse: Thorium se găsește în thorite (ThSiO4) și thorianit (ThO2 + UO2). Toriul poate fi recuperat din monzonit, care conține 3-9% ThO2 asociate cu alte pământuri rare. Metalul de toriu poate fi obținut prin reducerea oxidului de toriu cu calciu, prin reducerea tetraclorurii de toriu cu un metal alcalin, prin electroliza clorurii de toriu anhidru într-un amestec fuzionat de potasiu și cloruri de sodiu sau prin reducerea tetraclorurii de toriu cu clorură de zinc anhidră.
Clasificarea elementelor: Pământuri rare radioactive (actinidă)
Date fizice de toriu
Densitatea (g / cc): 11,78
Punctul de topire (K): 2028
Punctul de fierbere (K): 5060
Aspect: metal gri, moale, maleabil, ductil, radioactiv
Raza atomică (pm): 180
