Definiția și ecuația pH-ului în chimie
 Share
Share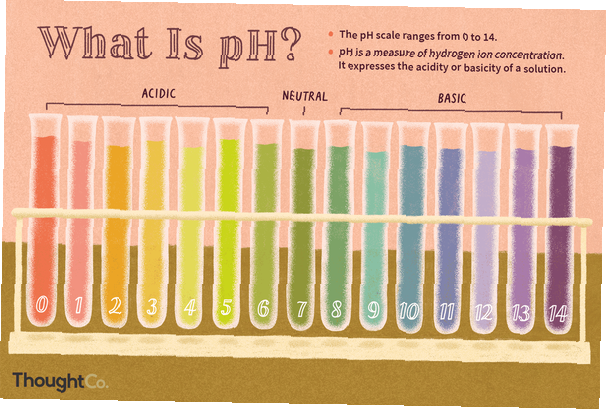
pH-ul este o măsură a concentrației ionilor de hidrogen, o măsură a acidității sau a alcalinității unei soluții. Scala de pH variază de obicei de la 0 la 14. Soluțiile apoase la 25 ° C cu un pH mai mic de 7 sunt acide, în timp ce cele cu un pH mai mare de 7 sunt bazice sau alcaline. Un nivel de pH de 7,0 la 25 ° C este definit ca fiind „neutru”, deoarece concentrația de H3O+ este egală cu concentrația de OH- în apă pură. Acizii foarte puternici ar putea avea un pH negativ, în timp ce bazele foarte puternice pot avea un pH mai mare de 14.
Ecuația pH-ului
Ecuația pentru calculul pH-ului a fost propusă în 1909 de biochimistul danez Søren Peter Lauritz Sørensen:
pH = -log [H+]
unde log este logaritmul de bază 10 și [H+] reprezintă concentrația ionilor de hidrogen în unități de alunițe pe litru soluție. Termenul „pH” provine de la cuvântul german „potenz”, care înseamnă „putere”, combinat cu H, simbolul elementului pentru hidrogen, deci pH-ul este o prescurtare pentru „puterea hidrogenului”.
Exemple de valori ale pH-ului substanțelor chimice obișnuite
Lucrăm cu mulți acizi (pH scăzut) și baze (pH ridicat) în fiecare zi. Exemple de valori ale pH-ului substanțelor chimice de laborator și a produselor casnice includ:
0: acid clorhidric
2.0: suc de lămâie
2.2: oțet
4.0: vin
7.0: apă pură (neutră)
7.4: sânge uman
13.0: lejer
14.0: hidroxid de sodiu
Nu toate lichidele au o valoare a pH-ului
pH-ul are semnificație doar într-o soluție apoasă (în apă). Multe substanțe chimice, inclusiv lichide, nu au valori ale pH-ului. Dacă nu există apă, nu există pH. De exemplu, nu există o valoare a pH-ului pentru uleiul vegetal, benzina sau alcoolul pur.
IUPAC Definiția pH-ului
Uniunea Internațională de Chimie Pură și Aplicată (IUPAC) are o scală de pH ușor diferită, care se bazează pe măsurători electrochimice ale unei soluții tampon standard. În esență, definiția folosește ecuația:
pH = -log aH+
unde unH+ reprezintă activitatea hidrogenului, care este concentrația eficientă a ionilor de hidrogen într-o soluție. Aceasta ar putea fi ușor diferită de concentrația reală. Scara pH-ului IUPAC include și factori termodinamici, care pot influența pH-ul.
Pentru majoritatea situațiilor, definiția standard a pH-ului este suficientă.
Cum se măsoară pH-ul
Măsurarea grosieră a pH-ului se poate face folosind hârtie litmus sau un alt tip de hârtie cu pH cunoscut pentru a schimba culorile în jurul unei anumite valori de pH. Majoritatea indicatorilor și hârtiilor de pH sunt utile doar pentru a spune dacă o substanță este un acid sau o bază sau pentru a identifica pH-ul într-un interval îngust. Un indicator universal este un amestec de soluții indicatoare destinate să ofere o schimbare de culoare pe un interval de pH de la 2 la 10.
Măsurători mai precise se fac folosind standarde primare pentru calibrarea unui electrod de sticlă și a pH-metrului. Electrodul funcționează prin măsurarea diferenței de potențial dintre un electrod cu hidrogen și un electrod standard. Un exemplu de electrod standard este clorura de argint.
Utilizări ale pH-ului
pH-ul este utilizat în viața de zi cu zi, precum și în știință și industrie. Este utilizat în gătit (de exemplu, praf de copt reacționat și un acid pentru a face ca produsele coapte să crească), pentru a proiecta cocktailuri, în curățători și în conservarea alimentelor. Este important în întreținerea bazinelor și purificarea apei, agricultură, medicamente, chimie, inginerie, oceanografie, biologie și alte științe.
