Calcule de masă moleculară
 Share
Share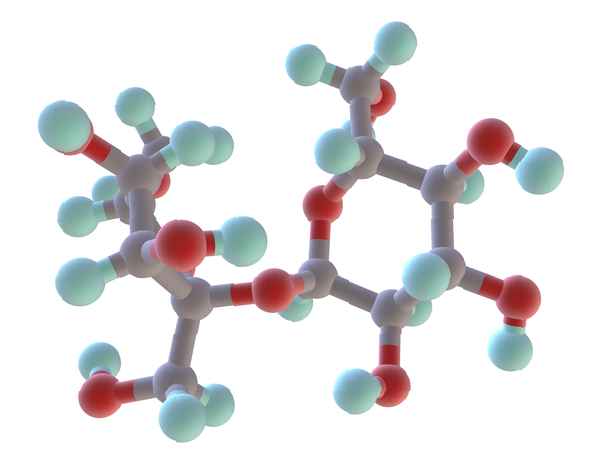
Masa moleculară a unei molecule este masa totală a tuturor atomilor care formează molecula. Acest exemplu de exemplu ilustrează modul de a găsi masa moleculară a unui compus sau moleculă.
Problema masei moleculare
Găsiți masa moleculară a zahărului de masă (zaharoză), care are o formulă moleculară C12H22O11.
Soluţie
Pentru a găsi masa moleculară, adăugați masele atomice ale tuturor atomilor din moleculă. Găsiți masa atomică pentru fiecare element, folosind masa dată în tabelul periodic. Înmulțiți abonamentul (numărul de atomi) de mai multe ori de masa atomică a acelui element și adăugați masele tuturor elementelor din moleculă pentru a obține masa moleculară. De exemplu, multiplicarea abonamentului de 12 ori mai mare decât masa atomică a carbonului (C). Vă ajută să cunoașteți simbolurile elementelor dacă nu le cunoașteți deja.
Dacă rotunjiți masele atomice la patru cifre semnificative, obțineți:
masa moleculară C12H22O11 = 12 (masa lui C) + 22 (masa lui H) + 11 (masa O)
masa moleculară C12H22O11 = 12 (12.01) + 22 (1.008) + 11 (16.00)
masa moleculară C12H22O11 = = 342,30
Răspuns
342.30
Rețineți că o moleculă de zahăr este de aproximativ 19 ori mai grea decât o moleculă de apă!
Când efectuați calculul, urmăriți cifrele dvs. semnificative. Este comun să lucrați corect la o problemă, dar obțineți răspunsul greșit, deoarece nu este raportat folosind numărul corect de cifre. Valorile apropiate contează în viața reală, dar nu este util dacă lucrați la probleme de chimie pentru o clasă.
Pentru mai multe practici, descărcați sau imprimați aceste foi de lucru:
- Fișă de masă cu formulă sau molară (pdf)
- Răspunsuri cu fișă de masă cu formulă sau molară (pdf)
Notă despre masa moleculară și izotopii
Calculele masei moleculare făcute folosind masele atomice de pe tabelul periodic se aplică pentru calcule generale, dar nu sunt exacte atunci când izotopii cunoscuți ai atomilor sunt prezenți într-un compus. Acest lucru se datorează faptului că tabelul periodic listează valori care sunt o medie ponderată a masei tuturor izotopilor naturali ai fiecărui element. Dacă efectuați calcule folosind o moleculă care conține un izotop specific, utilizați valoarea sa de masă. Aceasta va fi suma maselor protonilor și neutronilor săi. De exemplu, dacă toți atomii de hidrogen dintr-o moleculă sunt înlocuiți de deuteriu, masa pentru hidrogen ar fi 2.000, nu 1.008.
Problemă
Găsiți masa moleculară a glucozei, care are o formulă moleculară C6H12O6.
Soluţie
Pentru a găsi masa moleculară, adăugați masele atomice ale tuturor atomilor din moleculă. Găsiți masa atomică pentru fiecare element, folosind masa dată în tabelul periodic. Înmulțiți abonamentul (numărul de atomi) de mai mult de masa atomică a acelui element și adăugați masele tuturor elementelor din moleculă pentru a obține masa moleculară. Dacă rotunjim masele atomice la patru cifre semnificative, obținem:
masă moleculară C6H12O6 = 6 (12.01) + 12 (1.008) + 6 (16.00) = 180.16
Răspuns
180.16
Pentru mai multe practici, descărcați sau imprimați aceste foi de lucru:
- Fișă de masă cu formulă sau molară (pdf)
- Răspunsuri cu formulă de masă cu formulă sau Molas (pdf)
