Valența Valence Bond (VB) Definiția teoriei
 Share
Share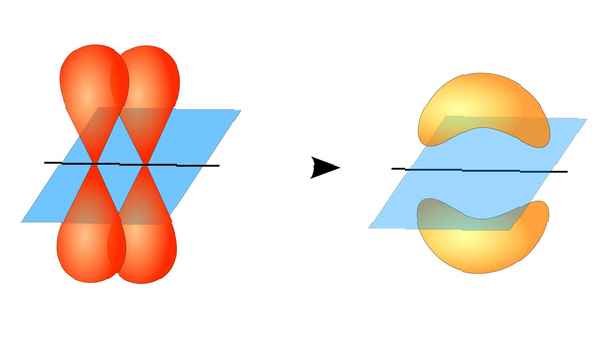
Teoria legăturii de valență (VB) este o teorie a legăturilor chimice care explică legătura chimică dintre doi atomi. Ca și teoria orbitalului molecular (MO), explică legarea folosind principii ale mecanicii cuantice. Conform teoriei legăturilor de valență, legătura este cauzată de suprapunerea orbitelor atomice pe jumătate umplute. Cei doi atomi împărtășesc unii electroni neperecheați pentru a forma un orbital umplut pentru a forma un orbital hibrid și se leagă împreună. Legăturile Sigma și pi fac parte din teoria legăturilor de valență.
Cheltuieli cheie: teoria Valence Bond (VB)
- Teoria legăturilor de valență sau teoria VB este o teorie bazată pe mecanica cuantică care explică modul în care funcționează legarea chimică.
- În teoria legăturilor de valență, orbitele atomice ale atomilor individuali sunt combinate pentru a forma legături chimice.
- Cealaltă teorie majoră a legării chimice este teoria orbitală moleculară sau teoria MO.
- Teoria legăturilor de valență este utilizată pentru a explica cum se formează legături chimice covalente între mai multe molecule.
Teorie
Teoria legăturilor de valență prezice formarea de legături covalente între atomi atunci când au orbitale atomice de valență pe jumătate umplute, fiecare conținând un singur electron nepereche. Acești orbitali atomici se suprapun, astfel încât electronii au cea mai mare probabilitate de a se afla în regiunea de legătură. Ambii atomi împart apoi electronii singuri neperecheți pentru a forma orbitali slab cuplati.
Cele două orbitale atomice nu trebuie să fie la fel ca unele cu altele. De exemplu, legăturile sigma și pi se pot suprapune. Legăturile Sigma se formează atunci când cei doi electroni partajați au orbitali care se suprapun cap la cap. În schimb, legăturile pi se formează atunci când orbitalii se suprapun, dar sunt paralele între ele.
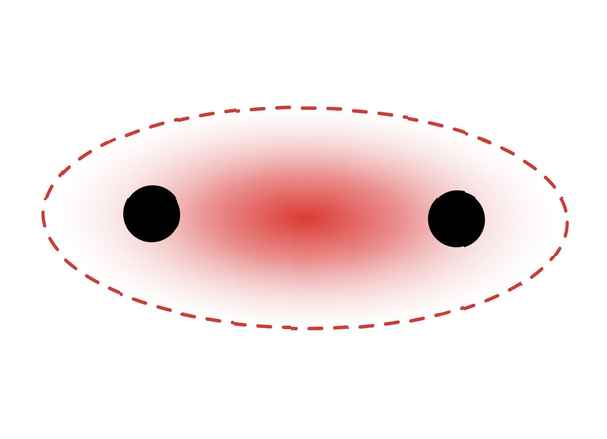 Această diagramă prezintă o legătură sigma între doi atomi. Zona roșie reprezintă densitatea electronilor localizați. ZooFari / Creative Commons Atribuire-Distribuire deopotrivă 3.0 Licență neportată
Această diagramă prezintă o legătură sigma între doi atomi. Zona roșie reprezintă densitatea electronilor localizați. ZooFari / Creative Commons Atribuire-Distribuire deopotrivă 3.0 Licență neportată Legăturile Sigma se formează între electronii a doi orbitali s, deoarece forma orbitală este sferică. Legăturile simple conțin o legătură sigma. Legăturile duble conțin o legătură sigma și o legătură pi. Legăturile triple conțin o legătură sigma și două legături pi. Când legăturile chimice se formează între atomi, orbitalii atomici pot fi hibrizi de legături sigma și pi.
Teoria ajută la explicarea formării de legături în cazurile în care o structură Lewis nu poate descrie un comportament real. În acest caz, mai multe structuri de legături de valență pot fi utilizate pentru a descrie o singură structură a lui Lewis.
Istorie
Teoria legăturilor de valență se bazează pe structurile lui Lewis. G.N. Lewis a propus aceste structuri în 1916, bazându-se pe ideea că doi electroni de legătură comună formau legături chimice. Mecanica cuantică a fost aplicată pentru a descrie proprietățile de legare în teoria Heitler-Londra din 1927. Această teorie a descris formarea de legături chimice între atomii de hidrogen din molecula H2 folosind ecuația de undă a lui Schrödinger pentru a îmbina funcțiile de undă ale celor doi atomi de hidrogen. În 1928, Linus Pauling a combinat ideea de legătură a perechilor lui Lewis cu teoria Heitler-Londra pentru a propune teoria legăturilor de valență. Teoria legăturilor de valență a fost dezvoltată pentru a descrie rezonanța și hibridizarea orbitală. În 1931, Pauling a publicat o lucrare despre teoria legăturilor de valență intitulată „Despre natura legăturii chimice”. Primele programe de calculator utilizate pentru a descrie legătura chimică au folosit teoria orbitală moleculară, dar din anii 1980, principiile teoriei legăturilor de valență au devenit programabile. Astăzi, versiunile moderne ale acestor teorii sunt competitive între ele în ceea ce privește descrierea exactă a comportamentului real.
utilizări
Teoria legăturilor de valență poate explica adesea modul în care se formează legăturile covalente. Molecula diatomică de fluor, F2, este un exemplu. Atomii de fluor formează legături covalente unice între ele. Legătura F-F rezultă din suprapunere pz orbitali, care conțin fiecare un singur electron nepereche. O situație similară apare în hidrogen, H2, dar lungimile și rezistența legăturii sunt diferite între H2 și F2 molecule. Se formează o legătură covalentă între hidrogen și fluor în acidul fluorhidric, HF. Această legătură se formează din suprapunerea hidrogenului 1s orbital și fluor 2pz orbital, care au fiecare un electron neperecheat. În HF, atât atomii de hidrogen cât și fluorul împart acești electroni într-o legătură covalentă.
surse
- Cooper, David L.; Gerratt, Iosif; Raimondi, Mario (1986). "Structura electronică a moleculei de benzen." Natură. 323 (6090): 699. doi: 10.1038 / 323699a0
- Messmer, Richard P.; Schultz, Peter A. (1987). "Structura electronică a moleculei de benzen." Natură. 329 (6139): 492. doi: 10.1038 / 329492a0
- Murrell, J.N .; Kettle, S.F.A .; Tedder, J. M. (1985). Legătura chimică (Ediția a 2-a). John Wiley & Sons. ISBN 0-471-90759-6.
- Pauling, Linus (1987). "Structura electronică a moleculei de benzen." Natură. 325 (6103): 396. doi: 10.1038 / 325396d0
- Shaik, Sason S.; Phillipe C. Hiberty (2008). Ghidul unui chimist în teoria valenței obligațiunilor. New Jersey: Wiley-Interscience. ISBN 978-0-470-03735-5.
